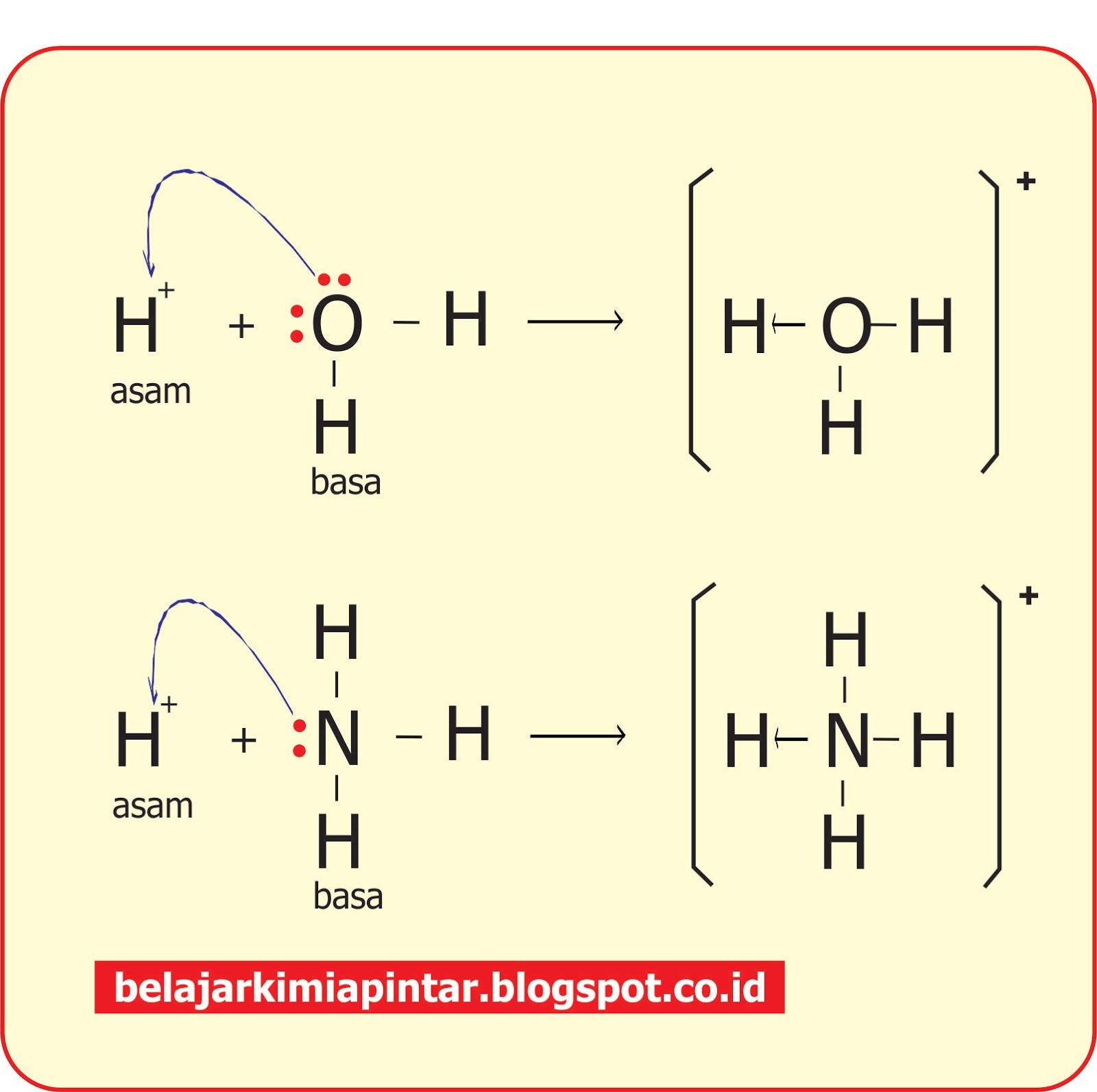
Ikatan kovalen adalah ikatan yang terjadi antara dua atau lebih atom non logam dengan pemakaian elektron secara bersama. Bentuk molekul tanpa elektron bebas. Simak molekul becl2 dengan menggunakan rumus lewis yang ditunjukkan gambar 2. 2. Sebagai atom pusat adalah. Adanya pasangan elektron bebas, seperti h 2 o, nh 3, dan pcl 3. Semakin besar selisih elektron yang dimiliki atom, maka semakin besar pula kepolaran ikatannya. Nh 3 memiliki satu pasangan electron bebas peb dan tiga pasangan electron ikatan pei. Satu pasangann electron bebas peb ini yang bisa digunakan unutk membentuk ikatan kovalen. Pasangan elektron bebas (peb) adalah pasangan elektron yang tidak digunakan untuk berikatan, contohnya pada molekul h2o terdapat dua peb. Terlihat pada gambar, atom pusat c memiliki empat pasangan elektron ikatan (pei) dan tidak memiliki pasangan elektron bebas (peb). Maka tipe molekulnya yaitu ax4. Elektron bebas berperan dalam membentuk ikatan kimia antara atom atau molekul. Struktur lewis adalah penggambaran ikatan kovalen yang menggunakan lambang titik lewis di mana pasangan elektron ikatan dinyatakan dengan satu garis atau sepasang titik. Pasangan elektron bebas adalah pasangan elektron yang tidak digunakan untuk berikatan dengan unsur lain. Untuk lebih mudah mengetahui jumlah pasangan elektron bebas pada ,. Teori asam basa lewis mampu menjelaskan sifat asam basa molekul atau ion yang mempunyai pasangan elektron bebas atau yang dapat menerima pasangan elektron. Untuk menentukan bentuk molekul berdasarkan teori domain elektron ini, quipperian harus mengetahui jumlah pasangan elektron ikatan (pei) dan pasangan. Molukul yang bersifat asam menurut teori lewis adalah bf 3 karena dapat menerima (akseptor) pasangan elektron bebas dari nh 3. Sedangkan nh 3 berdasarkan teori asam basa lewsi. Artikel ini menjelaskan cara menentukan geometri molekul berdasarkan pasangan elektron terikat (pei), pasangan elektron bebas (peb), dan domain elektron.